Інфаркт міокарда — захворювання, яке супроводиться некрозом окремих ділянок серцевого м’яза на грунті гострої ішемії, що виникає в результаті невідповідності вінцевого кровообігу потребам серцевого м’яза в кисні. Інфаркт міокарда часто називають коронаротромбозом, підкреслюючи цим провідну роль у походженні захворювання оклюзії вінцевої артерії тромбом. За класифікацією Всесвітньої організації охорони здоров’я, до інфаркту міокарда належать тільки крупноосередкові форми, тоді як у прийнятій в нашій країні класифікації виділяють і дрібноосередковий інфаркт міокарда, оскільки істотних відмінностей у боротьбі з цими двома формами ішемічної хвороби серця немає.
Етіологія і патогенез. В етіології інфаркту міокарда мають значення так звані фактори ризику: гіперхолестеринемія і гіпертригліцеридемія, «небезпечний» вік (після 40 років, особливо у чоловіків), обтяжена спадковість (наявність інфаркту міокарда у близьких родичів), обмежена фізична активність, гіпертонічна хвороба, цукровий діабет, ожиріння, куріння, психоемоційні напруження і стресові ситуації. Найчастішим фактором ризику інфаркту міокарда є стенокардія, особливо нестабільні (прогресуючі) її форми.
Оклюзію вінцевої артерії найчастіше спричиняє внутрішньосудинне зсідання крові і тромбоутворення (коронаротромбоз), рідше—атероматозна бляшка, крововилив у неї, емболія вінцевої артерії тромбами, що відірвались, і т. д.
Значне зменшення (і тимчасове припинення) кровообігу у м’язі серця може бути спричинене спазмом вінцевих артерій на грунті різко або слабко вираженого атеросклеротичного процесу.
До некоронарних причин виникнення інфаркту міокарда належить порушення метаболічних процесів у м’язі серця з наступними некротичними змінами в ньому (накопичення катехоламінів, порушення обміну електролітів та ін.).
Класифікація. Інфаркт міокарда класифікують за низкою ознак. Зокрема, у перебігу захворювання розрізняють такі періоди:
1) продромальний (період провісників тривалістю від кількох годин до місяця, цього періоду часто не буває);
2) дуже гострий (від розвитку ішемії до виникнення некрозу, триває від 30 хв до 2 год);
3) гострий (утворення ділянки некрозу і міомаляції, триває 2—10 днів, при затяжному й рецидивуючому перебігові довше);
4) підгострий (завершення початкових процесів організації рубця, заміщення некротизованої тканини грануляційною, триває до 4—5-го тижня від початку захворювання);
5) післяінфарктний (період остаточного формування й ущільнення рубця, адаптації міокарда до нових умов функціонування, триває до 3—6 місяців) . Кожен із цих періодів характеризується відповідними змінами ЕКГ.
За локалізацією інфаркт міокарда поділяють на передній, задній, бічний (можливі різні комбінації ділянок ураження).
Якщо протягом 8-тижневого періоду захворювання виникають нові осередки некрозу, кажуть про рецидивуючий інфаркт міокарда. Рецидиви бувають ранні (найчастіше протягом перших 7—10 днів) і пізні. До повторного інфаркту міокарда відносять випадки виникнення нового осередку некрозу тієї чи іншої локалізації не раніше як через 8 тижнів від початку першого.
Клінічна картина. Домінуючою ознакою інфаркту міокарда є біль у ділянці серця, але, на відміну від стенокардії, більш виражений, тривалий, що не купірується нітрогліцерином. Найчастіше біль має давлячий, стискуючий, сковуючий характер, як правило, іррадіює в ліве плече, ліву руку, шию, нижню щелепу, міжлопаткову ділянку. Іноді іррадіація захоплює кілька ділянок. Трапляється поширення болю в праву половину грудної клітки, праве плече і праву руку, в надчеревну ділянку, а також у більш віддалені від серця ділянки тіла. Можливі різні поєднання типової (ліва половина тіла) й атипової (надчеревна ділянка, права половина тіла) іррадіації болю.
Тривалість і інтенсивність болю значно варіюють. Він може бути короткочасним або тривати більше доби. В одних випадках захворювання розпочинається з одного приступу тривалого інтенсивного болю, в інших — виникає кілька приступів, з кожним із яких больовий синдром стає більш вираженим. Рідко біль має стертий характер. Фактично будь-який приступ стенокардії і навіть болю в ділянці серця у людини з факторами ризику ішемічної хвороби серця (особливо з кількома) повинен викликати підозру на можливий розвиток інфаркту міокарда. Інші клінічні ознаки, дані електрокардіографії, лабораторних досліджень можуть підтвердити або відкинути таке припущення.
Больовий приступ супроводиться загальною слабкістю, а збудження, що було на початку приступу, змінюється вираженою пригніченістю, відчуттям страху. Іноді посилюється потовиділення. Нерідко буває задишка.
Об’єктивно відзначають блідість або ціаноз шкіри і слизових оболонок, акроціаноз, тахіпное. Характерне виникнення стійкої тахікардії, рідше буває брадикардія, яка, коли не зумовлена порушенням провідності, звичайно короткочасна.
Зміни артеріального тиску найчастіше мають двофазний характер. Спочатку він помірно підвищується (до 22,7/13,3 кПа— 170/100 мм рт. ст.), а потім знижується. У пізніх стадіях гіпертонічної хвороби інфаркт міокарда призводить до розвитку так званої обезголовленої гіпертензії, коли систолічний тиск знижується, а діастолічний залишається високим (16/13,3—20/13,3 кПа, або 120/100 — 150/100 мм рт. ст.).
Характерними аускультативними ознаками інфаркту міокарда є ритм галопу, що свідчить про ослаблення скорочувальної здатності серцевого м’яза, і шум тертя перикарда.
У більшості хворих на інфаркт міокарда спостерігається температурна реакція, вираженість і тривалість якої залежать не тільки від розмірів осередку ураження, а й значною мірою від загальної реактивності організму. Максимум підвищення температури тіла спостерігається на 2—3-й день захворювання з наступним зниженням і нормалізацією до 7—10-го дня.
ЕКГ-діагностика. Серед додаткових методів дослідження основне практичне значення в діагностиці інфаркту міокарда має електрокардіографія. Вона ж дає змогу визначити локалізацію ураження. При інфаркті міокарда виділяють три зони, кожна з яких має свою ЕКГ-характеристику: 1) зона некрозу, що міститься в центрі (зміна комплексу QRS передусім збільшення або поява патологічного зубця Q); 2) зона ушкодження, що примикає до осередку некрозу (в основному зміщення сегмента S—Т); 3) зона ішемії, розташована далі до периферії (інверсія зубця Т). Наявність цих трьох зон, а також вплив їх одна на одну зумовлюють різноманітність ЕКГ-змін при інфаркті міокарда.
Утворення некрозу призводить до зниження електричного потенціалу ураженої ділянки міокарда, у зв’язку з чим електрорушійна сила буде спрямована у бік здорової тканини. На ЕКГ це проявляється поглибленням зубця Q. Одночасно знижується зубець R. Зубець Q вважають патологічним, якщо його тривалість перевищує 0,03 с, а амплітуда становить понад 25 % амплітуди зубця R у відведеннях III і а VF і понад 15 % у відведеннях V5 і V6. Слід мати на увазі, що в нормі у відведеннях V1-3 зубця Q немає і він з’являється, поступово збільшуючись, у напрямі до лівих грудних відведень. Зміщення сегмента S—Т також зумовлене відхиленням вектора S—Т у бік від осередку ураження. При деполяризації через те, що зона ушкодження не збуджується, вона позитивна щодо здорової тканини. Це призводить до підйому сегмента S—Т. Поява протилежного за напрямом до нормального процесу реполяризації спричиняє зміни зубця Т.
На характер ЕКГ впливає глибина некрозу. Так, при трансмуральному інфаркті міокарда виявляється комплекс QS замість QRS
На підставі ЕКГ-динаміки в перебігу інфаркту міокарда виділяють три стадії.
У першій (гострій) стадії, яка триває від кількох годин до 2—3 днів, спостерігається куполоподібний підйом сегмента S—Т і злиття його з позитивним зубцем Т. Сегмент S— Т відходить на високому рівні від низхідного коліна зубця R. У цей період може утворитися і патологічний зубець Q.
У другій (підгострій) стадії тривалістю до 3—4, рідко до 7 тижнів сегмент S—Т наближається до ізоелектричної лінії, формується негативний зубець Т (або з’являється в ньому негативна фаза) і надалі збільшується патологічний зубець Q (QS).
У третій стадії (рубцювання), що триває довго, сегмент S—Т повертається до ізоелектричної лінії, зубець Т негативний у вигляді рівнобедреного трикутника (коронарний), зберігається патологічний зубець Q. З часом сліди перенесеного інфаркту міокарда на ЕКГ можуть згладжуватись. Найчастіше це буває при інфаркті задньої стінки.
Топічна діагностика інфаркту міокарда базується на виявленні характерних ЕКГ-змін у відповідних відведеннях.
Передній інфаркт міокарда: провідні відведення І, aVL, V1-4 — при реєстрації ЕКГ у 12 відведеннях; А — при реєстрації ЕКГ за Небу; X — при реєстрації ортогональних відведень.
Передньобічний інфаркт міокарда; провідні відведення ті самі і додатково V5 і V6.
Задній інфаркт міокарда: провідні відведення III, aVF, Р, Y, а при задньобічному інфаркті додатково V5 і V6.
Особливості перебігу. Крім типового перебігу інфаркту міокарда (status anginosus), можуть бути атипові форми. Біль може локалізуватись не в ділянці серця, а в надчеревній ділянці (status gastralgicus). Іноді основним синдромом інфаркту міокарда є ядуха внаслідок гострої недостатності лівого шлуночка (status asthmaticus). Крім цих трьох форм, розрізняють шокову, аритмічну, церебральну, безсимптомну та ін.
Ускладнення інфаркту міокарда можуть бути поділені на ранні, у перші дні захворювання, і пізні, що настають після 2—3-го тижня від його початку. До ранніх ускладнень належать порушення ритму серця і провідності, кардіогенний шок, гостра недостатність серця, розрив серця, до пізніх— постінфарктний синдром, хронічна недостатність кровообігу. Такі ускладнення, як аневризма серця, тромбоемболія, трапляються в ранніх і пізніх стадіях інфаркту міокарда.
Порушення ритму серця і провідності є найбільш частим ускладненням гострого інфаркту міокарда, яке багато в чому визначає його перебіг і кінець. Воно виникає практично в усіх хворих у першу добу захворювання і більш ніж у половини хворих — на другу добу. Перше місце займає екстрасистолія. Політопні, групові і ранні шлуночкові екстрасистолії нерідко є провісниками шлуночкової тахікардії і фібриляції шлуночків. Приблизно у 25 % хворих реєструється передсердна екстрасистолія, яка може бути провісником пароксизмальної передсердної тахікардії, мигтіння або тріпотіння передсердь. Миготлива аритмія виникає приблизно у 10—25 % хворих на інфаркт міокарда, пароксизмальна передсердна тахікардія і тріпотіння передсердь — рідко (1—7 %); ще рідше — вузлова передсердно-шлуночкова тахікардія. Довго існуюча пароксизмальна тахікардія або тахіаритмія веде до розвитку недостатності серця й аритмогенного шоку. Найтяжчими порушеннями ритму серця е тріпотіння і мигтіння (фібриляція) шлуночків.
При інфаркті міокарда спостерігаються усі види порушення провідності. Значну небезпеку для хворих становить повна передсердно-шлуночкова блокада, і особливо асистолія.
Кардіогенний шок — одне з найтяжчих ускладнень інфаркту міокарда. Характеризується різким порушенням гемодинаміки внаслідок розладу механізмів нейрогуморальної регуляції.
Є. І. Чазов виділяє чотири форми шоку при інфаркті міокарда:
1) рефлекторний шок, в основі якого лежить больовий фактор (клінічний перебіг відносно легкий);
2) справжній кардіогенний шок, зумовлений головним чином порушенням скорочувальної здатності міокарда (перебіг тяжкий з класичною картиною шоку);
3) ареактивний кардіогенний шок — найтяжча форма із складним багатофакторним патогенезом (практично не піддається лікуванню);
4) аритмічний, або аритмогенний, кардіогенний шок, причиною якого є зниження хвилинного об’єму серця внаслідок тахі- або брадисистолії (пароксизмальна тахікардія і тахіаритмія, повна передсердно-шлуночкова блокада та ін.).
Основне значення в патогенезі кардіогенного шоку має зниження скорочувальної здатності міокарда, результатом чого є зменшення систолічного викиду, зниження артеріальної перфузії і коронарного кровообігу. При цьому може підвищуватись загальний периферичний опір (особливо, при ареактивному шоку), а це більше посилює порушення гемодинаміки. У деяких хворих загальний периферичний опір залишається нормальним або навіть знижується.
Гіповолемія й артеріальна гіпотензія призводять до розвитку ацидозу, що негативно позначається на інотропній функції міокарда. Гіпоксія й ацидоз зумовлюють підвищення проникності судинної стінки, розширення прекапілярних артеріол і звуження посткапілярних венул. Капілярний об’єм крові різко збільшується, настає секвестрація крові. В результаті цього, а також внутрішньо-судинного зсідання, погіршання реологічних властивостей крові з виникненням сладж-синдрому різко порушується мікроциркуляція.
Клінічно визначаються виражена і тривала артеріальна гіпотензія (пульсовий тиск 2,7 кПа — 20 мм рт. ст. і нижче), блідість шкіри, часто з ціанотичним відтінком, іноді виражений акроціаноз, холодний піт, малий частий пульс, порушення функції нирок до розвитку анурії. Можливі порушення ритму серця, психомоторне збудження або адинамія, сплутаність або тимчасова втрата свідомості, розлади шкірної чутливості, зміна сухожильних рефлексів.
Аневризма серця являє собою обмежене випинання стінки однієї з камер серця із збільшенням її об’єму. Аневризма може бути гострою (формується в перші тижні інфаркту міокарда) і хронічною (виникає в пізні строки внаслідок випинання зони рубця). Найбільш частою локалізацією аневризми є стінка лівого шлуночка (у 60 % випадків — передньобічна стінка і верхівка). При трансмуральному інфаркті міокарда ризик розвитку аневризми підвищується. Формуванню аневризми серця може сприяти неадекватне для хворого фізичне навантаження в гострому періоді захворювання.
Для аневризми характерна наявність патологічної пульсації у прекардіальній ділянці в гострому періоді інфаркту міокарда. Нерідко верхівковий поштовх посилений (пульсація аневризми), а пульс слабкого наповнення і напруження (симптом Казем-Бека). При локалізації аневризми біля верхівки пальпується подвійний серцевий поштовх. Деформація поштовху і патологічна пульсація реєструються за допомогою апекскардіограми. Аускультативно часто виявляється ритм галопу, а також протяжливий систолічний шум, зумовлений течією крові в період систоли між аневризмою і камерою серця, розширенням шлуночка, функціональною недостатністю мітрального клапана.
Істотне значення для діагностики аневризми має відсутність зворотної динаміки ЕКХ («застиглий» дугоподібний підйом S—T). При реєстрації з місця пульсації записується комплекс QS.
Приблизно у 3/4 хворих аневризма супроводиться тромбоендокардитом, що проявляється субфєбрильною температурою тіла, збільшенням швидкості осідання еритроцитів і підвищенням кількості лейкоцитів у крові.
Одним із грізних ускладнень аневризми є розрив серця.
Розрив серця — наскрізне порушення цілості всіх щарів серця, Що виникає, как правило, внаслідок обширного трансмурального інфаркту міокарда.
Розрив серця найчастіше спостерігається у віці після 60 років, при високому артеріальному тискові, обширному інфаркті міокарда і наявності аневризми серця. Його розвиткові сприяють фізичне й емоційне напруження, недодержання рухового режиму в гострому періоді захворювання.
Найчастіше розрив серця виникає в період з 2-го по 14-й день від початку захворювання, коли процес міомаляції найбільш виражений.
Смерть при розриві серця найчастіше настає раптово внаслідок рефлекторної зупинки або тампонади серця (здавлення серця кров’ю, яка заповнила порожнину перикарда) . Якщо хворий переживає момент прориву крові в перикардіальну порожнину, то спостерігається клінічна картина шоку. Летальний кінець настає через кілька хвилин, рідше — годин. В останньому випадку наростають ознаки тампонади серця: ціаноз верхньої половини тіла, а потім і всього тулуба, різке набрякання шийних вен, малий частий пульс, спад артеріального тиску, розширення площі абсолютної серцевої тупості.
Розрив міжшлуночкової перегородки при інфаркті міокарда діагностується за такими ознаками:
1) поява грубого систолічного, а можливо, й діастолічного шуму в III—IV міжребер’ї зліва від грудини або біля верхівки серця;
2) наростання гострої недостатності кровообігу за правошлуночковим типом (набрякання шийних вен, збільшення печінки, поява периферичних набряків, на ЕКГ — ознаки перевантаження правих відділів серця);
3) порушення передсердношлуночкової і внутрішньошлуночкової провідності. Смерть при розриві міжшлуночкової перегородки настає на 6—33-й день, рідко хворі живуть місяці і роки.
Розрив (відрив) сосочкових м’язів характеризується раптовою появою грубого систолічного шуму внаслідок гострого розвитку недостатності мітрального клапана. Одночасно з’являються ознаки шоку і наростаючої недостатності кровообігу за лівошлуночковим типом. Тривалість життя хворих не перевищує доби.
Тромбоемболія як ускладнення інфаркту міокарда виникає, за даними різних авторів, у 23—60 % випадків. При цьому сприяючими факторами є повторний, задній і задньобічний інфаркт міокарда, поєднання інфаркту міокарда з цукровим діабетом, вік понад 60 років.
Постінфарктний синдром (синдром Дреслера) характеризується класичною тріадою ознак: дифузний перикардит, плеврит і пневмонія (найчастіше, однак, виражена одна чи дві ознаки), супроводиться значним підвищенням температури тіла. В основі його лежить аутоалергічний механізм, пов’язаний із сенсибілізацією організму антигенами, що надходять із некротизованої ділянки міокарда. Виникає на 2—6-му тижні захворювання. Описані також випадки більш раннього і більш пізнього розвитку синдрому.
В разі прогресування синдрому запальний процес може поширюватись на синовіальні оболонки (тривка артралгія), грудинно-реберні суглоби (синдром передньої грудної стінки), іноді приєднуються дерматит, геморагічний васкуліт, гострий гломерулонефрит.
Перебіг синдрому рецидивуючий з періодами загострення і ремісії. Ремісії виникають під впливом лікування кортикостероїдами, відміна яких, особливо якщо вона проведена швидко, часто знову призводить до загострення. Тривалість кожного рецидиву від 1—2 тижнів до і— 2 місяців.
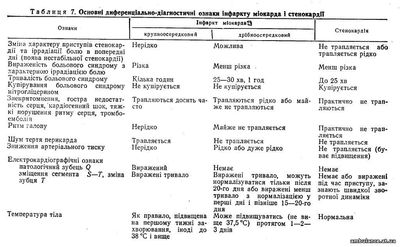
Диференціальна діагностика у типових випадках інфаркту міокарда не становить труднощів. Проте в ряді випадків, особливо на ранніх етапах захворювання, можуть виникнути труднощі в трактуванні тих чи інших симптомів.
Інфаркт міокарда диференціюють передусім із стенокардією (табл.7).
Невідкладна допомога. Хворим на інфаркт міокарда подають спеціалізовану допомогу, яку на догоспітальному етапі здійснюють спеціалізовані кардіологічні бригади. Поява провісників інфаркту міокарда потребує термінової госпіталізації хворого в інфарктне відділення, оскільки адекватне лікування у продромальному періоді дає змогу іноді запобігти розвиткові захворювання. Однак коли є порушення гемодинаміки, серцевого ритму і в разі ускладненого інфаркту (кардіогенний шок, гостра недостатність лівого шлуночка з набряком легень) кардіологічна бригада розпочинає лікування на місці.
Основні принципи лікування при інфаркті міокарда:
1) усунення больового синдрому;
2) зменшення невідповідності між енергетичними потребами міокарда і можливостями його кровопостачання;
3) боротьба з тромбоутворенням у системі вінцевих артерій та інших судинних басейнах;
4) корекція електролітного і кислотно-основного стану;
5) запобігання і ліквідація порушень ритму та провідності;
6) запобігання поширенню зони інфаркту міокарда.
При нерізкому больовому синдромі розпочинають внутрішньовенне введення суміші анальгіну з папаверином (або но-шпою) і димедролом (або дипразином, супрастином) у поєднанні з діазепамом (седуксеном). Коли немає ефекту або при різко вираженому приступі стенокардії до суміші додають дроперидол, а в разі потреби — наркотичні анальгетики (фентаніл, морфін) з атропіном (якщо немає тахікардії) або платифіліном (при тахікардії), натрію оксибутират.
Для нормалізації енергетичних процесів вводять препарати, які поліпшують коронарний кровообіг, центральну гемодинаміку і мікроциркуляцію. Застосовують нітрати швидкої дії (внутрішньовенно нітрогліцерин, наніпрус).
У тих випадках, коли фоном інфаркту міокарда є гіпертонічна хвороба, аритмія, можуть бути ефективними антагоністи іонів кальцію. Вони мають також антиангінальну дію і позитивно впливають на метаболізм міокарда, зменшують агрегацію еритроцитів, спричиняють діуретичний ефект. їх не слід застосовувати при кардіогенному шоку через небезпеку посилення артеріальної гіпотензії і при вираженій брадикардії, а також поєднувати з а-адреноблокаторами. Найчастіше застосовують фіноптин (ізоптин) по 2—4 мл 0,25 % розчину, фенігідин (коринфар) по 10 мг всередину.
При інфаркті міокарда, який супроводиться синусною або пароксизмальною тахікардією, екстрасистолією, миготливою аритмією без вираженої недостатності серця, можуть бути використані р-адреноблокатори. Найчастіше застосовують анаприлін (обзидан, індерал) по 1 — 2 мл 0,1 % розчину внутрішньовенно або до 40 мг усередину, тразикор по 20 мг усередину, талінолол (корданум) по 50 мг усередину. Ці препарати не слід поєднувати з антагоністами іонів кальцію.
Особливе місце займає боротьба з аритмією. Транспортують хворого в стаціонар тільки після усунення або зменшення аритмії, коли зникне загроза розвитку аритмогенного шоку. Щоб запобігти розвиткові шлуночкової тахіаритмії усім хворим на інфаркт міокарда безпосередньо перед транспортуванням внутрішньовенно вводять 4—5 мл 2 % розчину лідокаїну або тримекаїну в 20 мл 0,9 % розчину натрію хлориду.
Транспортування хворих має бути особливо щадним. їх не слід переодягати, усаджувати, у машину треба обов язково переносити на носилках. Під час переїзду треба вести постійний контроль гемодинаміки, при можливості — моніторний нагляд (кардіоскоп, ритмокардіометр, радіокомплекс «Тревога-2»).
Боротьба з кардіогенним шоком в умовах швидкої медичної допомоги становить значні труднощі і часто малоефективна. Проте при своєчасній госпіталізації в спеціалізовані інфарктні відділення вдається врятувати до 10 % хворих.
Лікування при кардіогенному шоку треба розпочинати з ліквідації больового синдрому і підвищення артеріального тиску. Больовий синдром звичайно купірують застосуванням наркотичних анальгетиків (промедол, морфін, фентаніл). Дозу препарату підбирають залежно од віку хворого, наявності порушення дихання. Так, в осіб старших вікових груп застосування внутрішньовенно 10 мг морфіну може спричинити пригнічення дихання, порушення його за типом дихання Чейна — Стокса, тому звичайно спочатку треба вводити не більше 5 мг морфіну (0,5 мл 1 % розчину). Морфін та його аналоги мають також судинорозширювальну дію, тому терапію наркотичними анальгетиками застосовують на фоні використання симпатоміметичних амінів.
Поліпшення оксигенації тканин у хворих з шоком досягають подачею кисню через носові катетери, введені до рівня ротової частини глотки, з швидкістю 10 л/хв.
Для підвищення артеріального тиску і поліпшення периферичного кровообігу використовують дофамін у дозі 2—10 мкг/(кг-хв). Якщо тиск при введенні високих доз дофаміну не підвищується або виникає значна тахікардія, приєднують норадреналін (2—20 мкг/хв). Вибір дози препарату і швидкості його введення визначається показниками артеріального і центрального венозного тиску.
При шоку в разі брадикардії (менше 50 ударів за 1 хв), зумовленої передсердно-шлуночковою або синоаурикулярною блокадою, а також при синусній брадикардії методом вибору є екстрена електростимуляція серця.
До введення ендокардіальнопу електрода можна застосовувати засоби, які поліпшують серцевий ритм: адреналін— 0,3—0,4 мл 0,1% розчину, новодрин — 0,1— 0,2 мл 0,5 % розчину, продовжувати інфузію дофаміну, преднізолону (ЗО—60 мг). При пароксизмальних порушеннях серцевого ритму передусім вводять антагоністи іонів кальцію (ізоптин не більше 5 мг повільно внутрішньовенно), лідокаїн, тримекаїн і рідше—новокаїнамід. Інфузію цих засобів при шоку здійснюють на фоні застосування симпатоміметичних амінів.
До комплексу лікування хворих з кардіогенним шоком обов’язково має бути включене застосування гепарину (коли немає ознак внутрішньої кровотечі). Його вводять весь час внутрішньовенно краплинно, час зсідання крові підтримують у межах 15—20 хв.
Внаслідок того, що серцеві глікозиди спричиняють звуження периферичних і вінцевих судин, збільшують постнавантаження, сприяють виникненню аритмій, їх застосування в перші 2—3 дні розвитку кардіогенного шоку не виправдане.
Периферичні вазодилататори, і передусім нітрогліцерин (сублінгвально по 1 таблетці через кожні 15 хв або внутрішньовенно краплинно), призначають тільки хворим з високим рівнем венозного тиску, а також у разі розвитку інтерстиціального набряку легень.
Набряк легень на фоні інфаркту міокарда має свої особливості, що визначаються розмірами осередку ураження серцевого м’яза та його локалізацією, порушеннями ритму і провідності. Набряк легень може проходити на фоні підвищеного, нормального і зниженого артеріального тиску. Залежно від цього різнитимуться і лікувальні заходи (табл. 8).
У будь-який період інфаркту міокарда (найчастіше — на початку захворювання) може виникнути припинення кровообігу (фібриляція шлуночків, асистолія), яке потребує застосування всього комплексу реанімаційних заходів за загальними правилами.
Госпіталізація. Хворих з крупноосередковим інфарктом міокарда госпіталізують у відділення (блоки) інтенсивного нагляду лікування і реанімації при інфарктних відділеннях, хворих з дрібноосередковим інфарктом міокарда — в інфарктні і кардіологічні відділення. Транспортують на носилках.